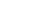NC|赵永娟教授等发现构象特异性纳米抗体——靶向烟酰胺单核苷酸激活状态SARM1
摘要
2022年12月9日,香港中文大学(深圳)医学院赵永娟团队及其合作者在Nature Communications(自然-通讯)杂志发表题为A conformation-specific nanobody targeting the nicotinamide mononucleotide-activated state of SARM1(一种靶向 SARM1 烟酰胺单核苷酸激活状态的构象特异性纳米体)的研究论文。研究人员利用康体生命抗体发现平台,用SARM1蛋白免疫羊驼并建立噬菌体库,通过噬菌体展示技术筛选出能够与SARM1激活状态构象特异结合的纳米抗体Nb-C6。SARM1的激活可导致细胞钙离子水平升高,与多途径诱导的周围神经病变有关。了解 SARM1的激活机制具有重要意义,Nb-C6能够特异结合并稳定激活状态的SARM1,Nb-C6帮助研究者探究了SARM1在激活过程中的结构变化,并可以对细胞中的活性 SARM1 进行成像和定位,提供了在活细胞中操纵 SARM1 的方法。

前言
正文
研究人员为了了解 SARM1激活状态的结构,采取了利用纳米抗体(Nb)稳定SARM1活性形式结构的方法。研究人员用重组的SARM1与弗氏佐剂混合免疫羊驼。经过6轮免疫后,从外周淋巴细胞提取mRNA,并在此基础上构建了纳米抗体文库(图1),利用噬菌体展示技术筛选到了多条能与SARM1结合的阳性克隆。其中,Nb-C6能够特异识别 NMN 激活的 SARM1。
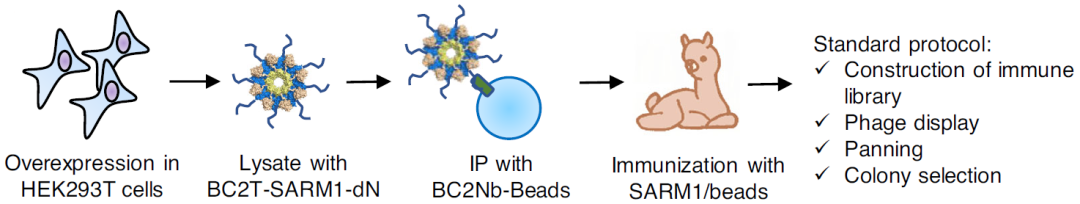
图1 Nb-C6的研发流程
研究人员用表面等离子体共振(SPR)技术测试了在不同浓度配体溶液中Nb-C6与SARM1的结合情况,在高 NAD 浓度(1.6 mM)下,Nb-C6 与 SARM1 的结合非常低。随着配体浓度转变至100 µM NMN,Nb-C6与 SARM1的结合比例增加到了60%以上,其线性拟合图和结合示意图如图2所示,表明 NAD / NMN 比率决定了 Nb - C6与SARM1的结合,Nb-C6能够特异结合NMN激活状态下的SARM1。
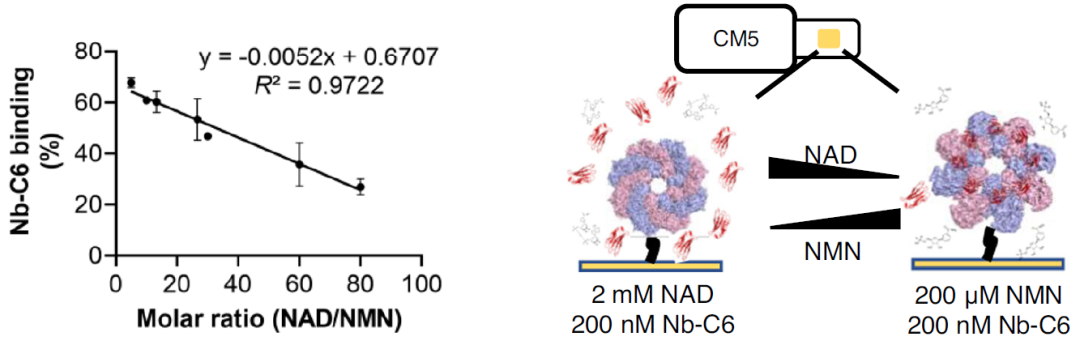
图2 Nb-C6指示并促进SARM1的激活
研究人员进一步测试了与mNeonGreen (mNG,一种荧光标记蛋白)融合表达的Nb-C6可视化检测细胞中激活形式的SARM1的能力。表达了SARM1 的HEK 293 细胞用CZ-48(能够穿透细胞膜的NMN类似物)处理,成像结果表明,Nb-C6的结合在 CZ-48 激活 SARM1 后显著增加,证实了其构象特异性并表明线粒体定位的 SARM1 的激活经历了构象变化。此外,作者还发现Nb-C6单独在体外可以激活SARM1,但与NMN和两者一起激活相比效果明显较弱。他们还证明,在内源表达和诱导表达SARM1的两种HEK 293细胞中过度表达Nb-C6(C6-YFP)导致cADPR水平升高,表明内源性和诱导性SARM1分别被激活。在过度表达不相关Nb的对照细胞中没有观察到cADPR的增加。上述结果充分验证了 Nb-C6 仅识别 SARM1 的激活形式,最低限度地识别非活性形式,表明 Nb-C6 是激活活细胞内源性和外源性 SARM1 的有价值的工具。
图3 (a) Nb-C6 对 CZ-48 激活的 SARM1 进行染色,表达SARM1的 HEK293 细胞用 1 μg/mL 多西环素处理 12 小时,然后用 100 μM CZ-48 处理 6 小时,固定细胞并分别用 C6-mNeonGreen、抗 SARM1多克隆抗体、线粒体染料Tom20染色。水平比例尺:5 μm;(b)Nb-C6 染色和抗 SARM1 染色信号的比率。
为深入了解SARM1的激活机制,研究人员通过冷冻电子显微镜获得了SARM1NMN/Nb-C6 复合物的结构(分别率:2.7 Å),复合物含两层八聚环,包含16个SARM1和16个Nb-C6。Nb-C6 主要与 SAM 结构域结合并在 C 末端二聚化,稳定整个结构。SARM1NMN 的整体结构呈“盛开的莲花”形状(图 3a-c),与 SARM1NAD 紧凑的“甜甜圈”结构(图4)形成鲜明对比。 相较于SARM1NAD, ARM-TIR 域作为一个整体从 SAM 域摆动并旋转~139°。NMN 结合暴露区域后,SARM1 的这种大构象变化被 Nb-C6 识别,说明其仅对 NMN 激活的 SARM1 具有特异性。
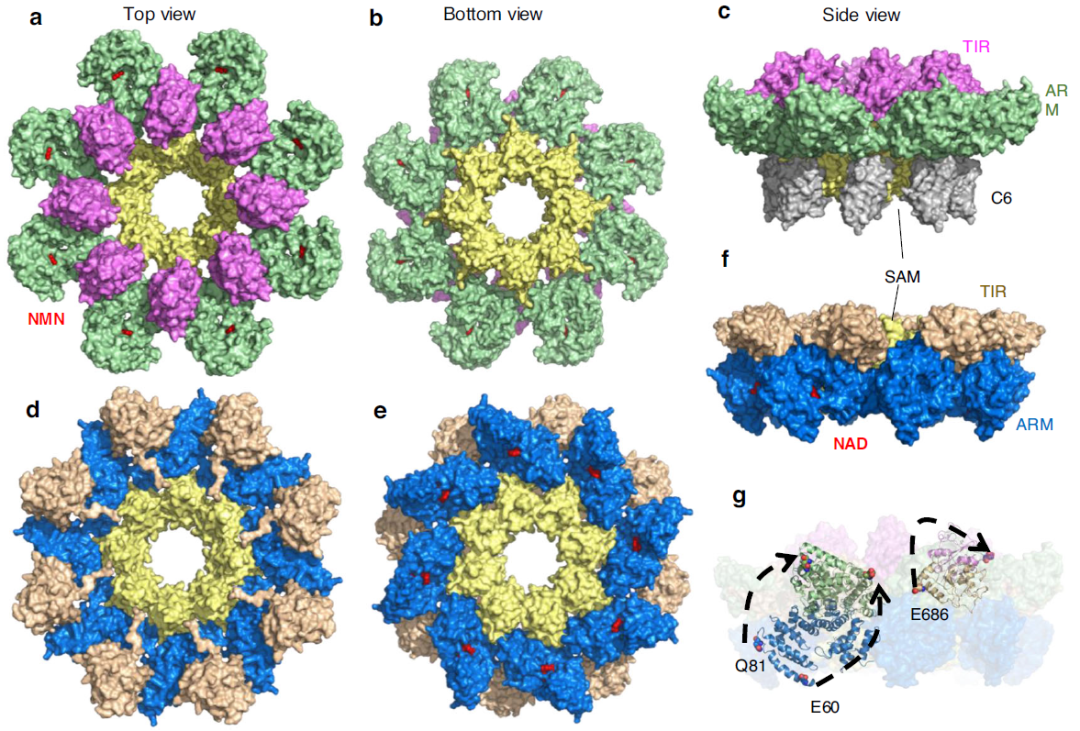
图4活化和非活化状态下 SARM1 的冷冻电镜结构。a–c SARM1NMN/Nb-C6 复合物的结构,(a)顶视图; (b) 底视图;(c) 侧视图; SARM1 和 Nb-C6 显示为表面模型,ARM 域为绿色,TIR 域为品红色,SAM 域为黄色,Nb-C6 为灰色,NMN 显示为红色球体。d-f SARM1NAD (PDB 7ANW) 的整体结构。 (d) 顶视图; (e) 底视图; (f) 侧视图;SARM1 显示为表面模型,ARM 域为蓝色,TIR 域为小麦色,SAM 域为黄色,NAD 显示为红色的球体模型。(g) NMN 和 NAD 结合的 SARM1 叠加的侧视图。为清楚起见,只有一个 NMN 结合和 NAD 结合形式的SARM1显示为卡通模型,其他结构被淡化,SARM1NMN 复合物中的 Nb-C6 被隐藏。SARM1NMN 的颜色与图(a–c) 中一样,SARM1NAD 的颜色与图 (d–f) 中一样;ARM 域中的残基 E60 和 Q81 以及 TIR 域中的 E686 显示为球体;相应残基的重新定向由黑色箭头指示。
研究人员通过分析结构数据,深入的解析了NMN诱导的SARM1激活机制,发现NMN 结合位点与 NAD 的结合位点相同,并通过ARMNMN 和 ARMNAD 之间的结构差异解释了为何NMN 是激活剂而 NAD 是抑制剂。NMN/NAD 结合位点处的突变可以消除神经元中SARM1对烟酰胺核糖诱导的NMN 积累的反应。作者还发现ARM 域的向内弯曲对于 NMN 诱导的 SARM1 激活是必要的。接下来,作者研究了 NMN 诱导的 ARM 弯曲如何导致其从 SAM 域解离,并发现纳米抗体主要与 SAM 域结合,较小程度上与 ARM-SAM 连接子结合。Nb-C6 和 SAM 域之间的结合界面在很大程度上与ARM:SAM 界面重叠(图 5),这说明 Nb-C6 无法识别非活性 SARM1,因为结合位点被 ARM 遮盖了。
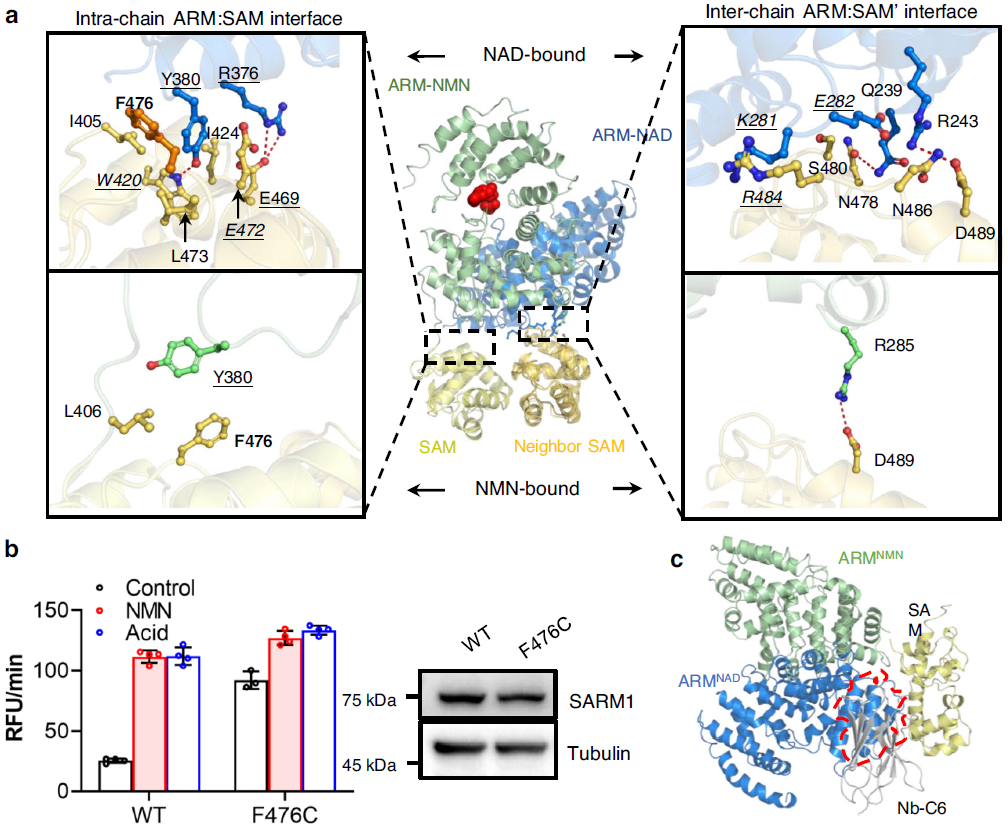
HDX-MS (氢氘交换质谱)和 XL-MS(交联质谱) 数据表明 NMN 激活的 SARM1 在溶液中经历了一系列 ARM 和 TIR 结构域重排。因此,Nb-C6 稳定结构可能代表这种最终激活状态的中间体。如图 6 所示,在这个最终状态下,TIR 域从 ARM 脱离并直接与相邻的 TIR 相互作用,形成多聚体并导致酶促活动。这种构象变化与 ARM 结构域重排相结合,有助于 SARM1 外围环的分解。


图6 SARM1在非激活和激活状态间的转换模型
小结
SARM1 因其在轴突退变(AxD)中的作用而受到关注。SARM1 是 NADase 和自我调节信号酶,可生成 cADPR 和 NAADP。SARM1 的激活是由细胞内 NAD 的减少引起的,可在诸如紫杉醇诱导的周围神经病变情况下发生; NMN也可激活 SARM1。研究人员发现了一种构象特异性纳米抗体Nb-C6,通过多种实验证明了Nb-C6仅稳定并结合激活状态的 SARM1,并利用Nb-C6实现了活细胞中激活状态的SARM1的成像与定位。Nb-C6帮助作者获得了SARM1在激活状态的冷冻电镜结构,联合HDX-MS 和 XL-MS 方法,深入解析了SARM1的激活机制。纳米抗体相较于传统抗体有更优秀的理化性质,在生物学和医学领域有诸多应用。 康体生命提供一站式纳米抗体发现服务,欢迎咨询与交流!